Другий енергетичний рівень атома — це захоплюючий світ, де електрони танцюють у чітко визначених орбіталях, створюючи основу для хімічних зв’язків і властивостей елементів. Уявіть собі невидиму арену, де частинки рухаються за законами квантової механіки, формуючи унікальні «будинки» для електронів. У цій статті ми зануримося в деталі цього рівня, розберемо, які орбіталі його складають, як вони функціонують і чому це важливо для науки та нашого розуміння природи.
Що таке енергетичний рівень і чому другий рівень особливий?
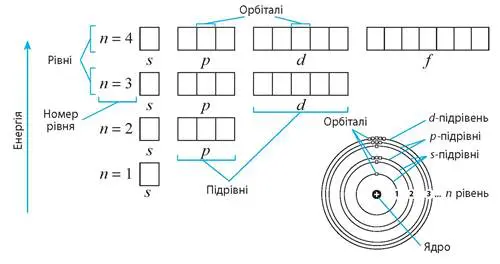
Енергетичні рівні — це певні «поверхи» в атомі, де електрони обертаються навколо ядра. Кожен рівень характеризується певною енергією і може вмістити обмежену кількість електронів. Другий енергетичний рівень, позначений як n=2, є другим за віддаленістю від ядра і має унікальну структуру, яка дозволяє йому відігравати ключову роль у хімічних реакціях.
Чому другий рівень особливий? Він містить не лише прості s-орбіталі, як перший рівень, а й більш складні p-орбіталі, що додають різноманітності в поведінку електронів. Цей рівень може вмістити до 8 електронів, що відповідає правилу октету — основі стабільності багатьох атомів у періодичній таблиці.
Основні характеристики другого рівня
Щоб зрозуміти, які орбіталі входять до другого рівня, важливо знати його ключові параметри:
Головне квантове число: Для другого рівня n=2, що визначає його енергію та розмір. Максимальна кількість електронів: Формула 2n² дає 8 електронів (2 × 2² = 8). Типи орбіталей: s- і p-орбіталі, які мають різні форми та орієнтації.
Ці характеристики роблять другий рівень універсальним, дозволяючи атомам таких елементів, як вуглець, азот чи кисень, формувати складні молекули, які лежать в основі життя.
Які орбіталі входять до другого енергетичного рівня?
Другий енергетичний рівень складається з двох типів орбіталей: однієї s-орбіталі та трьох p-орбіталей. Кожна з них має унікальну форму, розмір і роль у розміщенні електронів. Давайте розглянемо їх детально.
s-орбіталь другого рівня (2s)
s-орбіталь — це сферична «хмара», яка оточує ядро атома. На другому рівні вона позначається як 2s. Її форма нагадує ідеальну кулю, але вона більша за розміром, ніж 1s-орбіталь першого рівня.
Місткість: 2 електрони. Форма: Сферична, із рівномірною густиною електронної хмари. Енергія: Нижча, ніж у p-орбіталей другого рівня, оскільки s-орбіталі ближче до ядра.
Цікаво, що 2s-орбіталь має так звану «вузлову поверхню» — область, де ймовірність знайти електрон майже нульова. Це робить її дещо складнішою, ніж 1s, і додає унікальності в розподіл електронів.
p-орбіталі другого рівня (2p)
p-орбіталі — це три окремі орбіталі, позначені як 2px, 2py і 2pz. Кожна має форму гантелі, орієнтованої вздовж однієї з трьох просторових осей (x, y, z).
Місткість: Кожна p-орбіталь вміщує 2 електрони, тобто загалом 6 електронів для всіх трьох. Форма: Дві долі, розділені вузловою площиною, що проходить через ядро. Енергія: Трохи вища, ніж у 2s, через більшу відстань від ядра.
p-орбіталі додають просторову різноманітність, дозволяючи електронам займати різні орієнтації. Це критично для формування ковалентних зв’язків, наприклад, у молекулах води чи метану.
Загальна структура другого рівня
Отже, другий енергетичний рівень включає:
| Тип орбіталі | Кількість орбіталей | Місткість (електронів) | Форма |
|---|---|---|---|
| 2s | 1 | 2 | Сферична |
| 2p | 3 | 6 | Гантелеподібна |
Джерело даних: основи квантової хімії, підручники з атомної структури (наприклад, домен LibreTexts.org).
Ця структура дозволяє другому рівню бути «будівельним майданчиком» для багатьох елементів періодичної таблиці, таких як бор, вуглець, азот і кисень.
Як орбіталі другого рівня впливають на хімічні властивості?
Орбіталі другого рівня визначають, як атоми взаємодіють один з одним. Їх форма, енергія та орієнтація впливають на типи хімічних зв’язків, які може утворювати елемент.
Роль s-орбіталей
2s-орбіталі часто беруть участь у формуванні сигма-зв’язків — міцних ковалентних зв’язків, що утворюються при перекритті орбіталей. Наприклад, у молекулі водню (H₂) s-орбіталі перекриваються, створюючи стабільний зв’язок.
Роль p-орбіталей
p-орбіталі відіграють ключову роль у формуванні як сигма-, так і пі-зв’язків. Наприклад, у молекулі азоту (N₂) три p-орбіталі кожного атома утворюють потрійний зв’язок, що робить цю молекулу надзвичайно стабільною.
Саме p-орбіталі дозволяють вуглецю утворювати різноманітні органічні сполуки, від простого метану до складних полімерів, що лежать в основі життя.
Порівняння з іншими енергетичними рівнями
Щоб краще зрозуміти другий рівень, порівняймо його з першим і третім рівнями:
Перший рівень (n=1): Містить лише одну 1s-орбіталь (2 електрони). Простіший, але обмежений у хімічній активності. Третій рівень (n=3): Включає s-, p- і d-орбіталі, що вміщують до 18 електронів. Складніший, але менш поширений у легких елементах.
Другий рівень — це «золота середина», що забезпечує баланс між простотою та функціональністю, роблячи його ключовим для хімії.
Цікаві факти про орбіталі другого рівня
Орбіталі другого рівня — це не просто абстрактні поняття, а справжні «герої» хімії! Ось кілька захоплюючих фактів про них:
🌟 Різноманітність форм: p-орбіталі нагадують гантелі, але їх орієнтація вздовж осей x, y, z дозволяє електронам «танцювати» в тривимірному просторі, створюючи унікальні молекулярні структури. 🔬 Квантовий парадокс: Електрони на 2s-орбіталі мають область, де їх неможливо знайти (вузлову поверхню), що суперечить класичним уявленням про рух частинок. 🧪 Основа життя: Вуглець використовує 2s і 2p-орбіталі для створення чотирьох ковалентних зв’язків, що робить його «королем» органічної хімії. ⚡ Енергетична близькість: Різниця в енергії між 2s і 2p настільки мала, що електрони легко переміщуються між ними, сприяючи хімічним реакціям.
Типові помилки при вивченні орбіталей другого рівня
Вивчення орбіталей може бути складним, але знання типових помилок допоможе уникнути плутанини:
❌ Змішування орбіталей і орбіт: Орбіталі — це не траєкторії руху електронів, а області, де їх найімовірніше знайти. Не плутайте їх із планетарними орбітами! ⚠️ Неправильна місткість: Дехто думає, що кожна орбіталь вміщує лише один електрон. Насправді кожна 2s чи 2p може вмістити два електрони з протилежними спінами. 🔍 Ігнорування вузлових поверхонь: Студенти часто забувають, що 2s-орбіталь має вузлову поверхню, що впливає на її хімічну поведінку. 📉 Нерозуміння енергії: Дехто вважає, що 2s і 2p мають однакову енергію. Насправді 2p трохи вища за енергією.
Практичне значення другого енергетичного рівня
Знання про орбіталі другого рівня має величезне значення в науці та промисловості:
Органічна хімія: Вуглець і кисень використовують 2s і 2p-орбіталі для створення молекул, від палива до ліків. Матеріалознавство: Розуміння орбіталей допомагає створювати нові матеріали, такі як полімери чи напівпровідники. Квантова хімія: Моделювання молекул на комп’ютерах спирається на дані про орбіталі.
Другий енергетичний рівень — це не просто теорія, а ключ до розуміння того, як влаштований світ на молекулярному рівні.
Розуміння орбіталей другого рівня відкриває двері до світу хімії, де кожен електрон відіграє свою роль у створенні речовин, які нас оточують. Від молекул води до складних органічних сполук — усе починається з цих невидимих, але надзвичайно важливих структур.